まとめ
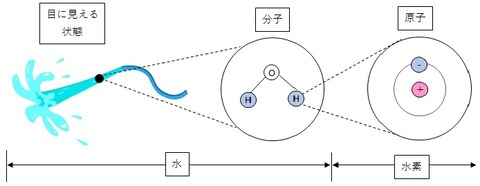
原子 分子を構成しているものの単独の呼び方(H2Oなら、H(水素)とO(酸素))
(上記の水の例だと、分子と違い、ここまで小さくすると、水と呼べなくなる)
また、その原子の種類は元素と呼ぶ
分子 目の前の物質が、その物質であるといえる(水なら水(H2O)と呼べる)もっとも小さい状態
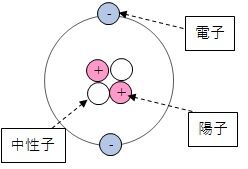
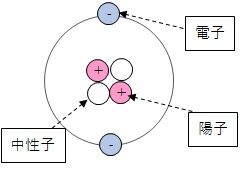
原子の構成 原子の外側を原子番号と同じ数の、マイナスの電荷を持つ電子が漂っており、
原子の中心には、原子核があり、
プラスの電荷を持つ陽子(原子番号と同じ数ある)
と、
電荷を持たない、中性子がある。
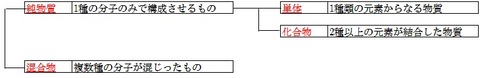
純物質 1種類の分子で構成される物質
例:水素(H2)、水(H2O)
純物質は単体と化合物に分かれる。
単体 : 1種類の元素からなる物質(例 H2)
化合物: 2種類以上の元素からなる物質 (例 H2O)
混合物 二つ以上のの種類の分子が交じり合っている物質
(例 食塩水(水と食塩の混合物) 、 泥水)
同位体 同じ元素の種類だが、原子核の中の中性子の数が違うもの
基本的にすごく不安定な物質になる。 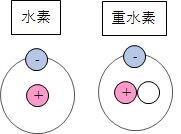
(例 水素(中性子なし)と重水素(中性子1個))
同素体 同じ元素でできているが、分子の並び方が異なり、性質も異なるもの
(例 炭素とダイヤモンド)
異性体 同じ数、同じ種類の原子を持っているが、 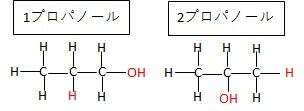
分子の中の原子の配列が異なる構造を
している物質
(例 1プロパノール、2プロパノール)
本文
物質は、原子と呼ばれるものが集合してできています。
原子は水素、ヘリウム、リチウム・・・。と現在118種類あります。
この原子が1種類だけ集合したり、他の元素と結合して別の物質をつくることで、物体を構成しています。
原子は原子核と呼ばれる
陽子(+の電荷を持つ粒子)
と
中性子(複数陽子をひっつけて原子核にする糊のような役割をするもの)
でできた核の周りを電子(-の電荷を持つ粒子)
が漂った構造をしています。
この電子と陽子の数の違いで、原子は様々な種類に分かれます。

そして、原子は、原子同士が化学的に結合した分子と言う形をとり、この分子が寄り集まって、物質ができます。
水素ガスは水素原子が集合し、水素ガスを作っていますが、
水素原子(H)は、2つの原子が、化学的に結合し、H2と呼ぶ状態になります。
これを分子(水素分子)といいます。
この水素分子が、いくつもでき、分子同士が弱く結合(分子間力)でよわく結びついて、水素ガスになります。
この、1種類の原子で構成される物質は単体と呼びます。
一方、水はH2Oと呼ばれていますが、
2つの水素原子(H)と、1つの酸素原子(O)が化学的に結合し、水素分子(H2O)を作ります。
この、水素分子が分子同士で弱く結合し、目に見える状態になったものが、水になります。
このように、2種類以上の原子で構成されるものを化合物と呼びます。
また、単体と化合物は1種類の分子でできているため、これらは純物質と呼ばれます。
一方、塩水みたいに、水と塩という二種以上の分子でできているものは、混合物と呼ばれます。
また、同じ原子でも、原子核の中性子の数が違ったり、構造が違えば、
目に見える大きさになったときの性質が異なります。
①同位体
水素原子は電子1個と陽子1個でできていますが、 
重水素と呼ばれるものは、中性子がさらに1個くっついたものです。
このように同じ元素でも中性子の数が違う物質を同位体と呼びます。
②同素体
黒鉛(シャーペンの芯等)は炭素原子(C)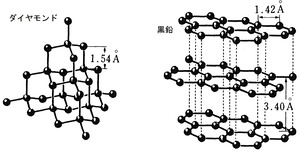
が集合してできています。
一方、ダイヤモンドも同じように炭素原子(C)
が集合してできたものです。
ただし、炭素原子の並び方は右のように違っており、
この違いが、黒鉛とダイヤモンドの違いを出してます。
この二つのような、同じ原子でできているが、並び方が違うものを同素体と呼びます。
③異性体
右の図の物質は 
炭素原子(C)3個
水素原子(H)8個
酸素原子(O)1個
でできていますが、赤字のところの、HとOHの位置が
逆になっております。
このような、同じ原子の数で構成される分子でも、構造がちがうものは
別の物質になります。これを異性体と言います。
今日は以上です。



コメント