まとめ
電池 イオン化傾向の違いによる電極間の電子の移動から電力を取り出すもの
両極は金属で、イオン化傾向が高いものが負極になる。
正極 電池において、電子を受け取る側
負極 電池において、電池を放出する側
起電力 電池の電圧 負極と正極のイオン化傾向の差が大きいほど、大きい

電気分解 外部から電圧をかけて、電子を電極間で移動させることにより、電解液中の物質に、電気的な反応を強制的に起こさせるもの。
目的によって、電極の材質は変わる。
陽極 電気分解するときにおいて、電子を放出する側
陰極 電気分解するときにおいて、電子を受け取る側
本文
この単元は、イオン化傾向を理解してないと難しいので、この記事を先に読んでください。
電池
上の記事で、亜鉛が塩酸に溶けることを勉強しました。
この現象を化学的に説明すると、イオン化傾向が低いイオンが存在する液体(電解質)にイオン化傾向が高い金属を入れると、
入れた金属が電子を放出してイオン化し、
液体中のイオンが電子を受け取り、液体から出てくる
ということでした。
ここで、電子を放出するという反応は電子を動かす力になるので、
亜鉛板に導線をつなげば、電力を取り出すことができます。
これを電池と言います。
ただ、電力を取り出すには、回路をつくらないといけないので、亜鉛板からひょろっと導線を伸ばすだけではダメです。
ということで、亜鉛板と銅板(亜鉛よりイオン化傾向が小さい金属)を導線で繋いで、銅イオンがある液体につけます。

すると、イオンになることで放出された電子が、導線を伝って銅板に届き、銅板の表面で、液体の中にある水素イオンが電子を受け取って水素になり、析出します。
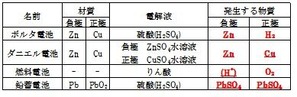
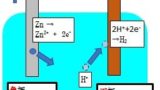
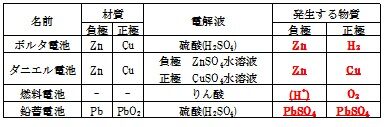
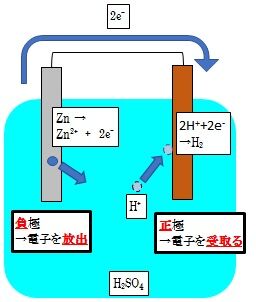
これはボルタ電池と呼ばれる電池です。
この時、亜鉛板のように、電子を放出する方を負極
銅板のようにイオンを受け取る側を正極と言います。
(電気回路の勉強で、電子が-極から+極に流れることを勉強したので、同じ関係性であることが理解できると思います。
ここでできた電池の電圧を起電力といいます。
起電力は、陽極と負極でイオン化傾向の差が大きいほど、起電力が大きい。
この電池では、陽極側に水素が発生します。
これは硫酸溶液の中にある水素イオンが、亜鉛から放出された電子を受け取って、水素になることで、発生します。
下の表によく出る電池の種類をまとめます。
電気分解
電池では、電極の金属のイオン化傾向の差を利用して電流を流すものでした。
電気分解は外部から電流を無理やり流し、二つの極の間の電子を移動させて、化学反応をさせるものです。
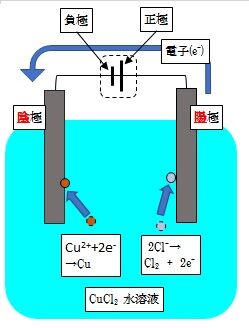
例として、塩化銅CuCl2水溶液の電気分解を見てみましょう。
電極は両方炭素棒を使ってみます。
まず、電池の正極に繋がっている電極は、陽極といいます。
負極につながっている電極は、陰極と言います。
ここで注意してほしいのが、
電池は負極から電子が発生します。この発生した電子は、負極とつながっている陰極で受け取ります。
一方、電池の正極では電子を受け取ります。なので、正極と繋がっている陽極は電子を放出します。
なので、電気分解の陽極、陰極の関係は電池の正極、負極の関係と逆になり、
陽極 : 電子を放出する
陰極 : 電子を受け取る
になります。
ここで、発生する物質について、
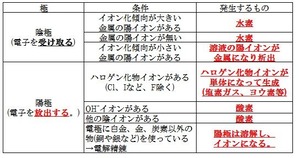
陽極では、溶液中のCl-イオンが電子を放出して、塩素ガス(Cl2)が発生
陰極では、溶液中のCu2+イオンが電子を受け取って、Cuが発生します。
電気分解で発生する物質として、大事な考え方は、
もともとイオンとして存在してもOKだった物質が、無理やり電流を流されることで、物質になって出てくる
ので、
イオン化傾向の低い物質が発生しやすいということです。
なので、溶液中にH+イオンはいるのですが、Cu2+のほうがイオンになりにくいので、陰極に析出します。
電気分解で発生する物質は以下表になります。

今日は以上です。
補足
電気分解の目的
なぜ、電気分解のようにわざわざ電流を流して、何かを分解しないといけないのでしょう。
ということで、工業的に電気分解は次のような使い方をします。
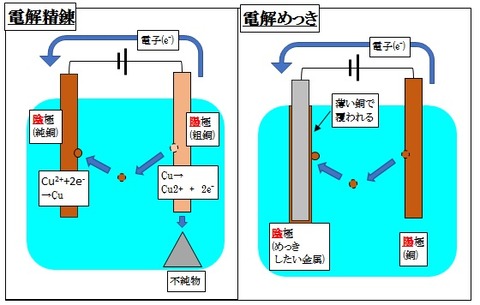
①電解精錬
銅製品を作る際に、原料の鉱石をいったん溶かして銅にするのですが、このままだと不純物が多く、
使い物になりません。
そこで、陽極に粗銅(純度の悪い胴)、陰極に純銅をつけ、電気分解します。
すると、陽極の粗銅は、イオンになります。
このとき、銅よりもイオン化しにくい不純物は、イオンにならずに陽極の下に泥のように溜まります。
そして、陰極で再度析出し、純度の高い銅ができます。
これを、電解精錬と呼びます。
簡単に高純度の金属ができるのですが、
①電気代がかかる
②製造速度が遅い
ので、主に銅、銀などの非鉄金属で使われます。
②電解めっき
陰極で金属が析出する際は、電極の表面を覆うように金属が析出します。
なので、表面を別の金属で覆いたいときに電解めっきを行います。
均一に表面をめっきできるのですが、やっぱり生産性が悪いので、
大量生産するものは、溶融した金属にドブ漬けし、ガスで余分な金属を落としてめっきします。


コメント