まとめ
・酸化反応 酸素を受け取る化学反応
水素を失う化学反応
電子を失う反応
電子を失う反応
・還元反応 酸素を与える(失う)反応
水素を得る化学反応
電子を得る反応
・酸化反応と還元反応は同時に起こる。
・酸化剤 反応相手を酸化させる材 自分は還元する
還元剤 反応相手を還元させる材 自分は酸化する。
還元剤 反応相手を還元させる材 自分は酸化する。
①酸化反応とは
今回は酸化と還元について説明します。
ものが燃えるということは燃やそうとしている物が酸素と化学反応を起こして、
別の物質になることです。
炭素を例にすると、
C + O2 → CO2
です。
これを見て見ると、
燃やす前は炭素という黒い個体だった物が、酸化され気体の二酸化炭素になります。
このような反応は酸化と呼び、物の形や色など性質が大きく変わります。
また、鉄は空気中の酸素と結合し、錆びます。
これも酸化反応で、
3Fe + 2O2 → Fe3O4
となります。
これも、
金属の鉄が、錆びたあと後にボロボロの赤茶けた錆びになり、性質が大きく変わると思います。
②還元反応とは
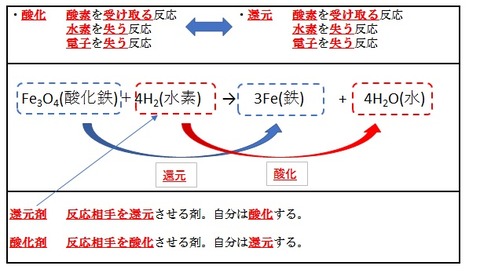
一方、錆びた鉄は水素と反応させることで元に戻すことができます。
Fe3O4 + 2H2 → 3Fe + 4H2O
酸化していた鉄が元の金属に戻ったので、これを
還元反応
と言います。
この酸化鉄に水素を反応させる反応を詳しく見ていきましょう。
鉄に着目すると、結合していた酸素を失います。
一方水素は、鉄にくっついていた水素を奪って水になりました。
この水素の反応は酸化と呼べるでしょう。
ということで、
酸化と還元は同時に起こります。
また、上の反応の水素のように、
反応相手(酸化鉄)を還元させる物質を還元剤と言います。
還元剤は相手を還元させるので、自分は酸化します。
一方、反応相手を酸化させる材料は酸化剤であり、
相手を酸化させると自分は還元します。
また、酸化は原子が持っている電子に着目すると、
広い意味では電子を失う反応という定義があります。
還元は逆に、電子を受け取る反応となります。
これについての詳しい説明は甲種を受ける際に勉強すればいいので、
乙4では、さらっとこんな定義があるんだというふうに流しましょう。
以上です。




コメント
図の酸化と還元の説明が同じです
ごめんなさい遅くなりました。
修正してます