まとめ
化学変化の例 : ・酸化、還元
・燃焼
・腐食
・電気分解 ・・・
(例) CH4 + 2O2 → CO2 + 2H2O
・反応式の左と右の原子の数は一致する。
・反応式の係数にしたがった量の反応となる。
(例) CH4 1モルに対し、H2Oは2モルできる。
反応速度(反応が進む速さ) は 反応する分子同士が衝突する頻度が多いほど反応しやすいので、
①反応前の物質の濃度が高い 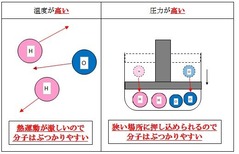
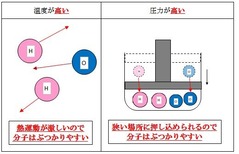
②圧力が高い
③温度が高い
④触媒がある。
触媒 : 化学反応の速度を速める物質
反応で発生する熱や、反応してできる物質の最終的な量が増えることはない。
反応を遅くする触媒もある(負触媒)
本文
化学反応は物理変化とことなり、原子のやり取りを行い、
反応前後でまったく別の物質に変化する反応です。
これに当てはまる反応は
①酸化(燃焼)
②還元
③腐食
④電気分解
などがあります。
それぞれ別のページで解説するので、今はこんなものがあるとだけ覚えましょう。
反応式とルール
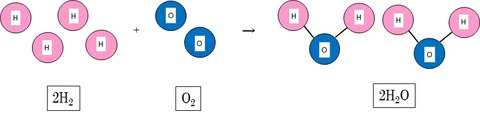
CH4 + 2O2 → CO2 + 2H2O (メタンガスの燃焼反応)
というような、→の左側に書いてある反応前の物質が反応し、右側の物質になる式を化学反応式と呼びます。
化学反応にもルールがあり、
①化学反応で使われる原子の数は、前後で変わらない。
(水素(H)と酸素(O)が反応しても、金(Au)になったりはしない。)
②反応式の係数にしたがった量の反応となる。
(メタンガスの燃焼の式を例にすると、CH4 1モルに対し、H2Oは2モルできる。)
があります。
これらを総合し、計算問題で出題されることが多いので、下のページで練習しましょう。

反応速度
化学反応は分子同士の結合であるため、分子同士が衝突する頻度が多いほど反応が進みます。
たとえば、反応する分子の数を増やせば、分子が衝突しやすくなります。
また、圧力や温度を変化させても、反応速度が上がります。
たとえば、温度を上げると、熱運動が激しくなるので、それだけ分子同士が衝突する頻度が上がります。
体積を減らして圧力を上げると、わずかなスペースの間に多くの分子が閉じ込められるので、
衝突する頻度が上がって、反応しやすくなります。
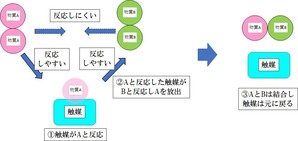
触媒
また、触媒という物質があります。
この物質は反応前後で、物質が変化することはありません。
ただし、AとBという反応しにくい物質の反応の橋渡しをする物質で、
反応速度を大きく上げることができます。
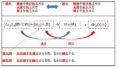
たとえば、上の図のように、Aと言う物質と触媒が反応し別の物質にいったんなります。
その後Aと反応した触媒が、Bと反応しやすくなり、触媒がAを排出して、ABの化合物を生成
その後、触媒は元の物質に戻るという動きをとります。
このように、通常なかなか反応しない物質を、触媒をつかって、化学反応させることができます。
今日は以上です。


コメント